¿Qué es el ácido oxálico?
El ácido oxálico, también llamado ácido etanedioico, es un compuesto orgánico incoloro, cristalino y tóxico que pertenece a la familia de los ácidos carboxílicos. El ácido oxálico se utiliza ampliamente como un enjuague ácido en las lavanderías, donde es eficaz para eliminar el óxido y las manchas de tinta porque convierte la mayoría de los compuestos de hierro insolubles en un ión complejo soluble.
Por la misma razón, es el principal constituyente de muchas preparaciones comerciales utilizadas para eliminar las incrustaciones de los radiadores de los automóviles. Es precisamente este último uso uno de los cuales ha impulsado con mayor fuerza la comercialización mundial del ácido oxálico. De hecho, podría decirse que cuenta con una eficacia para este fin sin precedentes.
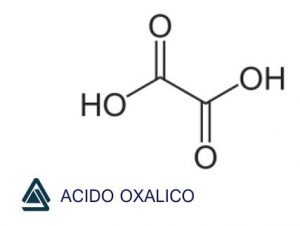
Fórmula del ácido oxálico
La fórmula del ácido oxálico es (C2H2O4); su forma habitual es la del hidrato cristalino, (COOH)2-2H2O. Conocido como un constituyente de la acedera de madera ya en el siglo XVII, el ácido oxálico se preparó sintéticamente por primera vez en 1776. Se fabrica calentando el formiato de sodio en presencia de un catalizador alcalino, oxidando los hidratos de carbono con ácido nítrico, calentando el aserrín con álcalis cáusticos o mediante la fermentación de soluciones azucaradas en presencia de ciertos moldes.
Etimología
Su nombre proviene de las plantas del género Oxalis, dado que está presente de forma natural en las mismas. Por la misma razón han sido identificadas sus sales por el botánico holandés Herman Boerhaave en las acederas en el año 1745.
Posteriormente las sales fueron aisladas en 1776 por el alemán Wiegleb. Así mismo, hasta la fecha puede decirse que han logrado localizarse más compuestos propios del ácido en alimentos comumente consumidos por el ser humano como lo son las espinacas y el ruibarbo. Esto da fe de lo sencillo que puede resultar encontrar dicho compuesto en la naturaleza.
Capacidad
Este ácido orgánico es también uno de los más poderosos que existen. En comparación con el ácido acético se ha determinado que es hasta 3000 veces más fuerte. Por otra parte, una de sus características es la presencia de bi-anión, mejor conocido como oxalato. Se trata de un agente quelante con la capacidad de ser también un agente reductor en términos químicos.
Cabe destacar que son muchos los iones metálicos que logran formar junto al oxalato precipitados insolubres. El mejor ejemplo de esto se encuentra en el oxalato de calcio. Dicho compuesto se ve con mayor presencia en los cálculos renales.

